Un hallazgo estructural en una proteína clave del HDL explica por qué algunas personas desarrollan aterosclerosis sin factores de riesgo clásicos
Un equipo internacional de científicos, con participación destacada del CONICET, logró identificar por primera vez una falla estructural en una variante de la proteína APOA1 —componente central del colesterol “bueno” (HDL)— que predispone al desarrollo temprano de enfermedades cardiovasculares. El descubrimiento, publicado en la prestigiosa Journal of Lipid Research, abre nuevas perspectivas para el diagnóstico y tratamiento de patologías que hasta ahora podían avanzar de forma silenciosa.
Cuando el colesterol “bueno” deja de proteger
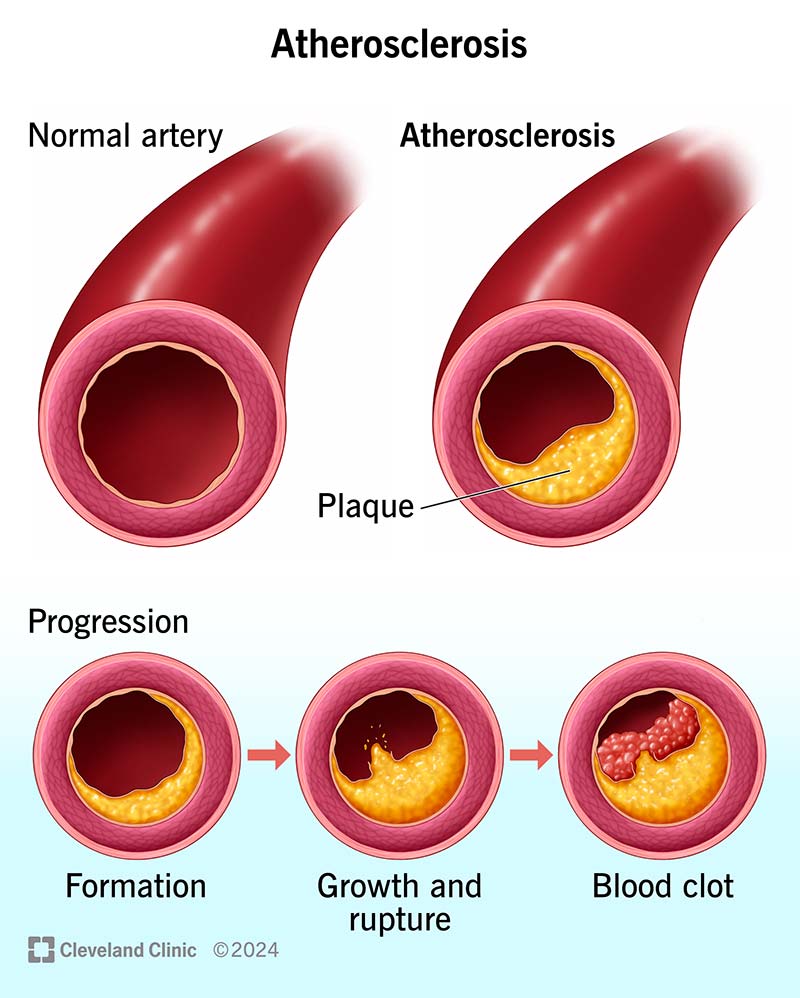
La aterosclerosis, una enfermedad caracterizada por la acumulación de placas de grasa en las arterias, suele asociarse a factores de riesgo conocidos como hipertensión, tabaquismo u obesidad. Sin embargo, existe un grupo de pacientes —muchos de ellos jóvenes— que desarrollan cuadros severos sin presentar ninguno de estos antecedentes. En varios de esos casos, la causa está en una mutación congénita de la proteína APOA1.
Descubierta en 1982, esta variante genética ya había sido vinculada a complicaciones cardiovasculares, pero durante más de 40 años se desconocía qué la volvía patogénica. “Siempre se buscó el problema en cómo funcionaba la proteína. Nosotros decidimos mirar su estructura”, explican los investigadores argentinos que participaron del estudio.
El giro clave: mirar la forma, no solo la función
Al no poder aplicar las técnicas clásicas de estudio estructural, el equipo desarrolló una estrategia innovadora que combinó biofísica avanzada y espectrometría de masas, en colaboración con la Universidad de Cincinnati (Estados Unidos). Así detectaron que la proteína mutada presenta anomalías importantes incluso cuando está sola, y especialmente cuando intenta asociarse con otras copias de sí misma.
Esa autoasociación es fundamental para que el HDL adopte su forma correcta y pueda retirar el colesterol acumulado en las arterias para llevarlo al hígado. Cuando el proceso falla, el colesterol “bueno” pierde su capacidad protectora.
Dos hipótesis que explican el daño
Los científicos plantean dos posibles consecuencias de esta alteración estructural. Por un lado, la proteína defectuosa podría formar agregados anómalos, incapaces de cumplir su función. Por otro, la falla impediría que el HDL alcance la forma y el tamaño adecuados para transportar eficazmente los lípidos, favoreciendo así la progresión de la aterosclerosis.
El hallazgo es especialmente relevante porque existen muchas otras mutaciones conocidas de APOA1 que podrían compartir un mecanismo similar. Comprender este defecto estructural podría, por lo tanto, ayudar a explicar otros casos de enfermedad cardiovascular de origen genético.
Impacto clínico y futuro
Hoy en día no se conoce con precisión cuántas personas portan esta variante en Argentina. Cuando aparecen los síntomas, el tratamiento suele limitarse a medicación estándar, sin abordar la causa biológica profunda. “Entender por qué algo funciona mal también nos enseña cómo debería funcionar bien”, señalan los autores, que destacan el potencial del descubrimiento para desarrollar nuevas herramientas diagnósticas y terapéuticas.
En un contexto donde las enfermedades cardiovasculares siguen siendo una de las principales causas de muerte en el mundo, este avance representa un paso clave para anticiparse a eventos graves antes de que ocurran.